Metody identyfikacji substancji i zagrożeń z nimi związanych – badanie rozpuszczalności związków
Badanie rozpuszczalności związków organicznych w określonych rozpuszczalnikach wykonywane jest w celu ustalenia charakteru badanej substancji. Konieczność ta podyktowana jest faktem, że rozpuszczalność jest ściśle związana z budową i obecnością grup funkcyjnych. Początkowe testy są źródłem informacji na temat charakteru badanego związku – obojętnego, kwasowego lub zasadowego. Próby te pozwalają więc na zaliczenie związku do odpowiedniej grupy rozpuszczalności, a to z kolei doprecyzowuje grupę z którą możemy mieć do czynienia i tym samym zawęża obszar w zakresie prowadzenia reakcji charakterystycznych mających na celu ustalenie grupy funkcyjnej. Do prowadzenia powyższych testów stosuje się siedem rozpuszczalników/roztworów:
- woda,
- eter dietylowy – (C2H5)2O,
- 5% roztwór wodorotlenku sodu – NaOH,
- 5% roztwór wodorowęglanu sodu -NaHCO3,
- 5% roztwór kwasu chlorowodorowego – HCl,
- stężony kwas siarkowy (VI) – H2SO4,
- 85% roztwór kwasu ortofosforowego (V) – H3PO4.
Powyższe rozpuszczalniki zostały podane zgodnie z kolejnością użycia w trakcie wykonywania badań, co ma swoje logiczne uzsadnienie. Wykonywanie prób rozpoczyna się od wody, gdyż jest ona dobrym rozpuszczalnikiem dla związków charakteryzujących się wyraźnie polarnymi cząsteczkami, w których udział części niepolarnej jest znikomy. Natomiast zła rozpuszczalność danego związku w etrze dietylowym potwierdza jego silną polarność. Jeżeli związek rozpuszcza się w wodzie i eterze, to można sądzić, że jest to związek niejonowy, zawiera nie więcej niż jedną grupę polarną oraz posiada nie więcej niż pięć atomów węgla w cząsteczce. Natomiast, jeżeli związek jest rozpuszczalny w wodzie, ale nie jest rozpuszczalny w eterze, to należy domniemywać, że jest to związek jonowy oraz zawiera więcej niż jedną grupę polarną. Kolejnym krokiem jest zbadanie rozpuszczalności w roztworze NaOH i HCl, co pozwala stwierdzić, czy badana substancja zawiera grupy funkcyjne kwasowe lub zasadowe. Zastosowanie stężonego kwasu siarkowego (VI) natomiast stwarza możliwość rozpoznania związków, które są słabymi zasadami, bądź stwierdzeniu czy badana substancja ulega lub nie ulega widocznym przemianom. Wykonywanie prób z użyciem stężonego H2SO4 może być procesem złożonym, któremu może towrzyszyć wydzielanie ciepła, wydzielanie gazów, czy też ściemnienie próbki. Efekty te wynikają między innymi z faktu, że kwas ten wykazuje silne właściwości higroskopijne.
Pozytywny efekt badania uznaje się wtedy, gdy związek rozpuści się w danym rozpuszczalniku, tj. stworzy z nim homogeniczną ciecz lub nie ulegnie dalszej przemianie w rozpuszczalniku do produktów o odmiennych właściwościach.
Efekt rozpuszczenia w określonych rozpuszczalnikach został podany w tabeli:
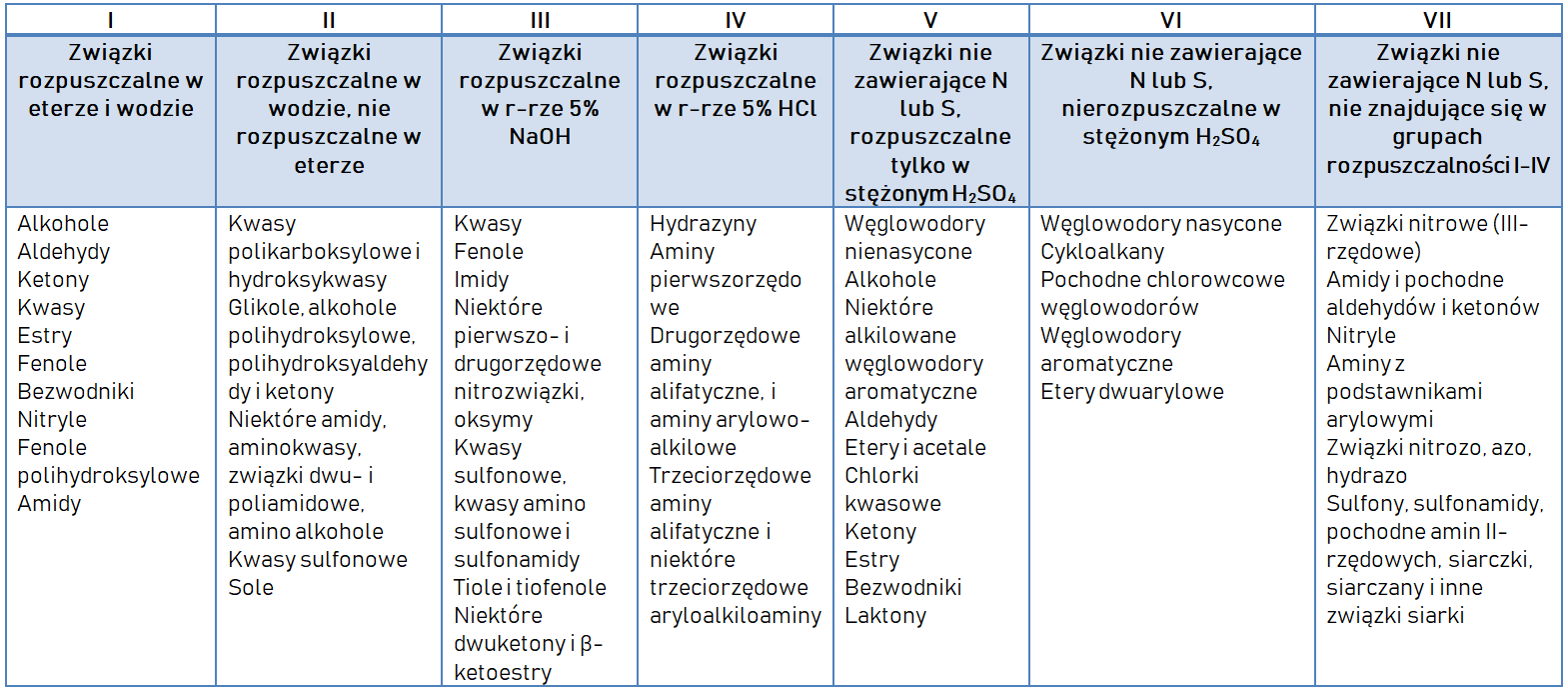
Wykonywanie prób powinno odbywać się zgodnie z kolejnością, która została zaprezenowana w poniższej tabeli. Pozytywny efekt próby (+) pozwala na zakwalifikowanie substancji do określonej grupy rozpuszczalności i umożliwia prowadzenie dalszych testów na grupy funkcyjne.
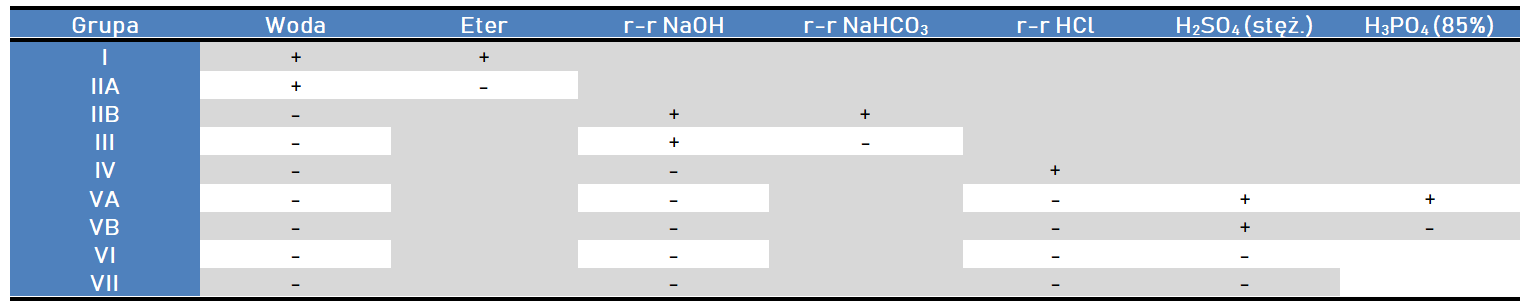
Dla pierwszych czterech grup rozpuszczalności korzystne jest również wykonywanie prób z kwaśnym węglanem sodu, ponieważ podczas niej możemy zaobserwować wydzielanie dwutlenku węgla. Opisany efekt reakcji, przy próbie wykonywanej dla związku zaliczonego do I grupy rozpuszczalności, może świadczyć o obecności grupy karboksylowej.


